Un approccio innovativo per studiare lo sviluppo dei tumori
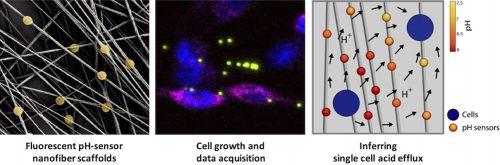
Una ricerca, pubblicata sulla rivista Acs Nano, condotta dall’Istituto di nanotecnologia del Consiglio nazionale delle ricerche di Lecce (Cnr-Nanotec) in collaborazione con un gruppo di ricerca del Politecnico, insieme all’Instituto Biofisika (Spagna), la Fondazione Ikerbasque (Spagna), l‘Istituto Italiano per la Medicina Genomica - IIGM - ente strumentale della Fondazione Compagnia di San Paolo, l’Università del Salento (Lecce) e l’Istituto tumori ‘Giovanni Paolo II’ Ircss di Bari, ha visto la realizzazione di una nuova piattaforma che ricostruisce l’ecosistema che sta alla base dello sviluppo dei tumori, partendo dall’analisi del metabolismo delle cellule. Questo tipo di studi, focalizzato sulle singole cellule, viene applicato in diversi ambiti, nelle patologie tumorali, nell’immunologia e nella neurologia, ed è importante perché individua meccanismi che non sarebbero identificabili attraverso indagini eseguite sull’intera popolazione cellulare. Tuttavia, le tecniche che attualmente vengono utilizzate per la misurazione delle caratteristiche metaboliche delle cellule sono molto spesso costose e invasive.
Il gruppo di ricerca è riuscito a creare un microambiente simile a quello naturale per lo sviluppo delle cellule tumorali, realizzando membrane nanofibrose contenenti sensori ottici che simulano la struttura della matrice extracellulare, la parte dei tessuti nei quali non sono presenti cellule. Queste membrane permettono di ricostruire, con un’elevata risoluzione spaziale e temporale, i flussi di protoni e le reti di scambio tra cellule all’interno di una popolazione cellulare eterogenea: le differenze tra singole cellule, infatti, influenzano fortemente il comportamento collettivo dei sistemi biologici e, di conseguenza, possono inficiare l’efficacia dei trattamenti medici. In questo senso, la scelta del modello di studio, il tumore del pancreas, è da considerarsi strategica perché questa patologia rientra tra i tumori big killer ed è particolarmente resistente ai trattamenti farmacologici.
Il risultato è stato ottenuto analizzando l'acidificazione di massa di una coltura tumorale, nota come effetto Warburg, che è un segno distintivo del cancro, abbiamo ricostruito il contributo apportato da ogni singola cellula. Si è potuto così constatare che l'acido lattico secreto dalle cellule donatrici funge sia da molecola di segnalazione nella comunicazione cellulare che da substrato per gli accettori.
“È importante notare che in questo ecosistema le cellule tumorali e non tumorali possono scambiarsi i ruoli, in contrasto con l’idea diffusa che le tumorali operino soprattutto come donatrici di acido lattico e non come accettori, ovvero come cellule che lo accolgono. Pertanto, le strategie che puntano a limitare la crescita dei tumori riducendo la loro capacità di espellere acido lattico potrebbero rivelarsi inefficaci” spiega Andrea De Martino, ricercatore del Dipartimento di Scienza Applicata e Tecnologia-DISAT al Politecnico.
Questo studio apre la strada all'analisi non invasiva, non costosa e in tempo reale del metabolismo delle singole cellule. La nuova piattaforma permetterà l'identificazione di nuove combinazioni farmacologiche che potrebbero rappresentare una svolta nel trattamento del tumore del pancreas.
Maggiori informazioni sulla ricerca sul sito internet del CNR a questo link